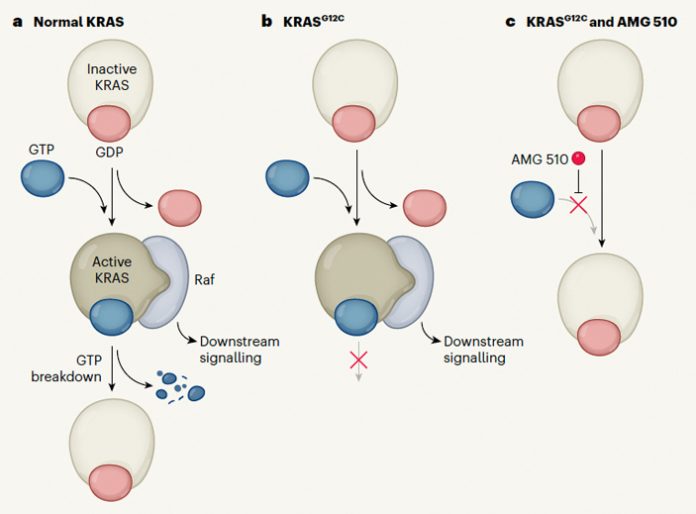
Рис. 1. Схема действия соединения AMG510. В нормальных тканях (a) белок KRAS активируется в результате замещения связанного с ним ГДФ на ГТФ. Из-за этого меняется конформация белка, что позволяет ему связаться с белком Raf и активировать сигнальные пути, контролирующие рост, деление и дифференцировку клеток. Затем ГТФ разрушается, белковый комплекс распадается, KRAS опять связывается с ГДФ, переходя в неактивное состояние. Мутантный белок KRASG12C не дает разрушиться молекуле ГТФ (b), поэтому комплекс с белком Raf остается перманентно активным, контроль над делением клеток теряется и они становятся раковыми. Молекула AMG 510 взаимодействует с KRASG12C предотвращая его связывание с ГТФ, лишая этот белок канцерогенной активности. Рисунок из популярного синопсиса к обсуждаемой статье в Nature
Примерно 20% случаев заболевания разными формами рака ассоциированы с мутациями в гене KRAS — важным элементом контроля за клеточным делением. Одна из наиболее частых мутаций — замена глицинового остатка на цистеиновый в позиции 12 (KRASG12C) — встречается примерно в 10% случаев рака легких. Уже несколько лет активно ведутся поиски эффективного ингибитора белков с такой мутацией. Недавно американским ученым удалось получить производное акриламида с техническим названием AMG 510, которое показало впечатляющие результаты: в экспериментах оно активно подавляло рост опухолей и вызывало их деградацию у мышей, а в доклинических испытаниях — и у людей. Дальнейшие эксперименты на мышах показали, что действие AMG 510 усиливается в комбинации с химиотерапевтическими средствами и с моноклональными противоопухолевыми антителами. При этом вылеченные мыши длительное время сохраняли иммунитет к повторному введению раковых клеток.
Успехи медицины в борьбе с инфекционными и сердечно-сосудистыми заболеваниями в последнее время выводят рак в лидеры как причину смерти человека. В некоторых развитых странах он уже занял это малопочетное первое место. По мере прогресса научных исследований стало понятно, что рак, в отличие, например, от оспы, полностью искоренить невозможно — способность нормальной живой клетки превратиться в злокачественную раковую является ее неотъемлемым свойством. И, к сожалению, является верным циничный постулат «раком должен заболеть каждый, просто многие до него не доживают».
Чтобы клетки и формируемые ими органы и ткани нормально функционировали, должен быть соблюден определенный баланс. С одной стороны, клетки должны размножаться (пролиферировать), с другой стороны, этот процесс должен быть контролируемым. Если какие-то клетки организма выходят из-под контроля и начинают неограниченно делиться, то образуются раковые опухоли. Этот баланс поддерживается при помощи специальных генов (и кодируемых ими белков): ряд генов работают на предотвращение неконтролируемой пролиферации (к таким относится, например, хорошо известный антионкоген TP53; см.: Главный борец с опухолями ген ТР53 может превращаться в онкоген, «Элементы», 11.11.2015), в то время как продукты других генов (протоонкогенов) стимулируют рост клеток. Мутации могут подавлять функции антионкогенов или усиливать функции протоонкогенов, превращая те и другие в онкогены.
Один из основных протоонкогенов — ген KRAS. Его мутации сопутствуют развитию опухолей при многих формах рака. Белок KRAS контролирует довольно сложный сигнальный путь ERK (аббревиатура от extracellular signal-regulated kinases, см. также MAPK/ERK pathway), передающий сигналы от рецепторов на поверхности клетки в ядро. Основная задача этого сигнального пути, присутствующего во всех клетках млекопитающих, — передавать сигнал от разных внеклеточных агентов (например, гормонов или факторов роста) в ядро, чтобы простимулировать деление клетки. Передача сигнала происходит по цепочке белков посредством передачи фосфатной группы, служащей своеобразным «переключателем». В случае мутации в каком-то из генов, кодирующих белки сигнального пути, этот «переключатель» может заклинить в положении, в котором клетка получает сигнал делиться. Такая ситуация — важный этап развития многих онкологических заболеваний.
Функция белка KRAS включается путем замены связанного с ним гуанозиндифосфата (ГДФ) на гуанозинтрифосфат (ГТФ), после чего он приобретает способность связаться с белком c-Raf и осуществить тем самым свою функцию в каскаде реакций MAPK/ERK (рис. 1, а). Далее ГТФ превращается в ГДФ, комплекс KRAS с c-Raf распадается, и белок KRAS деактивируется. В онкогенном KRAS, превращения ГТФ в ГДФ не происходит, его комплекс с Raf сохраняется и продолжает работать (рис. 1, b), что ослабляет контроль над делением клеток и способствует их превращению в раковые. Поэтому естественно, что уже неоднократно были предприняты попытки создать лекарства, подавляющие избыточную активность этого «самого вредного» онкогена (см., например, J. M. Ostrem et al., 2013. K-Ras(G12C) inhibitors allosterically control GTP affinity and effector interactions, M. P. Patricelli et al., 2016. Selective Inhibition of Oncogenic KRAS Output with Small Molecules Targeting the Inactive State).
Одной из мутаций, активирующих KRAS, является замена аминокислотного остатка глицина в положении 12 на цистеиновый. Такой вариант этого белка обозначают KRASG12C. Эта замена встречается достаточно часто (примерно в 12% случаев) в опухолях немелкоклеточного рака легких (см. Non-small-cell lung carcinoma) — формы заболевания, которая происходит из клеток эпителия бронхов и наблюдается примерно у 80% больных раком легких. В последние годы с помощью моделирования структуры белка и подбора подходящих молекул было синтезировано несколько химических соединений, связывающихся с тем же местом в структуре молекулы KRASG12C, с которым связывается и ГTФ. В результате подавляется образование комплекса ГТФ/KRASG12C и мутантный белок не активируется. Одно из таких соединений — производное акриламида, известное под лабораторным обозначением ARS-1620, — предотвращало активацию белка у модельных животных, но практически не влияло на опухоли больных людей (M. R. Janes et al., 2018. Targeting KRAS Mutant Cancers with a Covalent G12C-Specific Inhibitor), — вероятно, связь с мутантным KRASG12C была недостаточно сильной.
Исследования в этом направлении не останавливаются. И некоторое время назад исследователям из биофармацевтической компании Amgen в сотрудничестве с учеными из нескольких университетов США и Австралии удалось синтезировать более подходящий ингибитор KRASG12C. Это тоже производное акриламида, временно носящее техническое обозначение AMG 510. Рентгеноструктурное исследование комплекса AMG 510/KRASG12C показало, что по сравнению с ARS-1620 молекулы AMG 510 образуют дополнительные связи с остатком гистидина 95 молекулы KRASG12C (рис. 2). В результате сила связывания AMG 510 с KRASG12C увеличивается примерно в 10 раз. При этом AMG 510 не связывается с нормальным (немутантным) KRAS.
Рис. 2. Структурная формула AMG 510 (слева) и структура комплекса AMG 510 с молекулой белка KRASG12C по данным рентгеноструктурного анализа (в середине). Синий пунктир — связи Ван-дер-Ваальса, белый пунктир — гидрофильные связи, желтый пунктир — водородные связи белка с лигандом. Справа — наложение трехмерных моделей молекул ARS-1620 и AMG 510. Дополнительное кольцо молекулы AMG 510 обеспечивает прочную связь с ароматическим кольцом гистидинового остатка на 95 позиции белка KRASG12C. Рисунок из обсуждаемой статьи в Nature
Испытание AMG 510 на культурах клеток с мутацией KRASG12C показало, что в них практически полностью подавлено фосфорилирование в некоторых компонентах сигнального пути MAPK/ERK, из-за чего происходит резкое угнетение роста этих клеток (эффект намного сильнее в сравнении с ARS-1620). Что важно (хотя и было ожидаемо), клетки, не несущие KRASG12C, оказались нечувствительными к AMG 510.
Эксперименты с AMG 510 на лабораторных мышах с нормальной иммунной системой показали не только угнетение роста, но и деградацию опухолей, вызванных введением KRASG12C-содержащих клеток опухолей человека. При этом минимальная доза AMG 510, достаточная для проявления положительных эффектов, оказалась по крайней мере в 3 раза меньше, чем доза ARS-1620. Примечательно, что у иммунодефицитных мышей, лишенных способности продуцировать Т-клетки, под действием AMG 510 также наблюдалась регрессия опухолей, но не полное излечение: через некоторое время рост опухоли возобновлялся. Из этого следует, что терапевтический эффект AMG 510 может быть связан с иммунной системой.
Успех испытаний AMG 510 на культурах клеток и лабораторных мышах позволил получить разрешение на тестирование препарата в клинике. Тестирование проводилось на пациентах с немелкоклеточной карциномой легкого с мутацией KRASG12C. Результаты оказались весьма впечатляющими: компьютерная томография показала, что у пациентов наблюдалась существенная или даже полная деградация опухоли и метастазов (рис. 3).
Рис. 3. Результаты лечения больных раком легких. Компьютерные томограммы двух пациентов, больных аденокарциномой легких с KRASG12C. Слева — пациент, получавший по 180 мг AMG 510 ежедневно. У него опухоли и метастазы были локализованы в нижней доле правого легкого (верхний ряд изображений), в верхней доле левого легкого (средний ряд) и в лимфатическом узле (нижний ряд). Справа — пациент, получавший по 360 мг. У него опухоли и метастазы были локализованы в верхней доле левого легкого (верхний ряд), и в плевре (средний и нижний ряды). Хорошо видна деградация опухолей в процессе лечения. Опухоли второго пациента через 18 недель лечения оказались слишком маленькими для точной количественной оценки. Рисунок из обсуждаемой статьи в Nature
Далее авторы исследовали комбинированное воздействие AMG 510 с известными противораковыми лекарствами на культурах клеток и на лабораторных мышах. Совместное применение AMG 510 и ингибитора протеинкиназ МЕК (эти протеинкиназы связаны с сигнальными путями активации деления клеток, см. Mitogen-activated protein kinase kinase) действовало на опухоли мышей гораздо эффективнее, чем каждое из этих веществ по отдельности: через 30 дней после трансплантации опухолевых клеток у мышей, получавших комбинацию AMG 510+MEKi средний объем опухоли был примерно в 4 раза меньше. Аналогичный эффект давала и комбинация AMG 510 с другим противораковым цитостатическим препаратом карбоплатином.
Как уже говорилось, у мышей, лишенных способности продуцировать Т-клетки, введение AMG 510 не предотвращало рецидивы раковых опухолей. Поэтому ученые детально исследовали связь терапевтического эффекта AMG 510 с Т-клеточным иммунитетом, а конкретно — комбинированное воздействие на опухоли AMG 510 и моноклональных антител к белку PD-1 (Anti-PD-1). Белок PD-1 играет важную роль в отрицательной регуляции иммунной системы, предотвращая активацию Т-лимфоцитов, поэтому антитела к нему активно используются в клинике для лечения рака. В экспериментах на мышах с нормальным иммунитетом терапия с помощью только Anti-PD-1 существенно замедляла рост раковых опухолей, но их полное исчезновение наблюдалось лишь в одном на каждые десять случаев. А при комбинированной терапии AMG 510 и Anti-PD-1 полная регрессия опухолей и последующее выживание без опухолей наблюдались у девяти из десяти мышей несмотря на то, что лечение прекращали через 43 дня.
Иммуногистологические исследования, проводившиеся во время этой комбинированной терапии, выявили, что в опухолях активно накапливаются хемокины, вызывающие инфильтрацию опухолей убивающими раковые клетки Т-лимфоцитами и дендритными клетками, что характерно для противоракового иммунного ответа. Более того, если выжившим мышам вновь вводили раковые клетки, опухоли у них не вырастали. Это свидетельствует о длительном сохранении Т-клеточного иммунного ответа на клетки с мутацией KRASG12C.
Полученные результаты однозначно свидетельствуют о том, что вещество AMG 510 — как само по себе, так и в комбинации с другими противораковыми средствами — может сильным подспорьем в борьбе с разновидностями рака легких, связанными с мутацией KRASG12C. Эти результаты уже получили подтверждение в работах других исследовательских групп (см., например, J. Hallin et al., 2019. The KRASG12C Inhibitor MRTX849 Provides Insight toward Therapeutic Susceptibility of KRAS-Mutant Cancers in Mouse Models and Patients). Но многое еще требует прояснения. Например, пока не понятна природа установленной связи действия вещества AMG 510 с иммунным ответом и даже не подобраны оптимальные дозировки для комбинаций с другими препаратами. Также непонятно, насколько этот подход можно распространить хотя бы на формы рака легких, связанные с другими мутациями в гене KRAS, не говоря уже о других типах рака (попытки лечения колоректального рака с помощью AMG 510 оказались не слишком успешными). Но с уверенностью можно сказать, что обсуждаемая работа открывает сразу несколько перспективных направлений для дальнейших исследований и, можно надеяться, что в скором будущем расширит наш противораковый арсенал.
Источник: elementy.ru